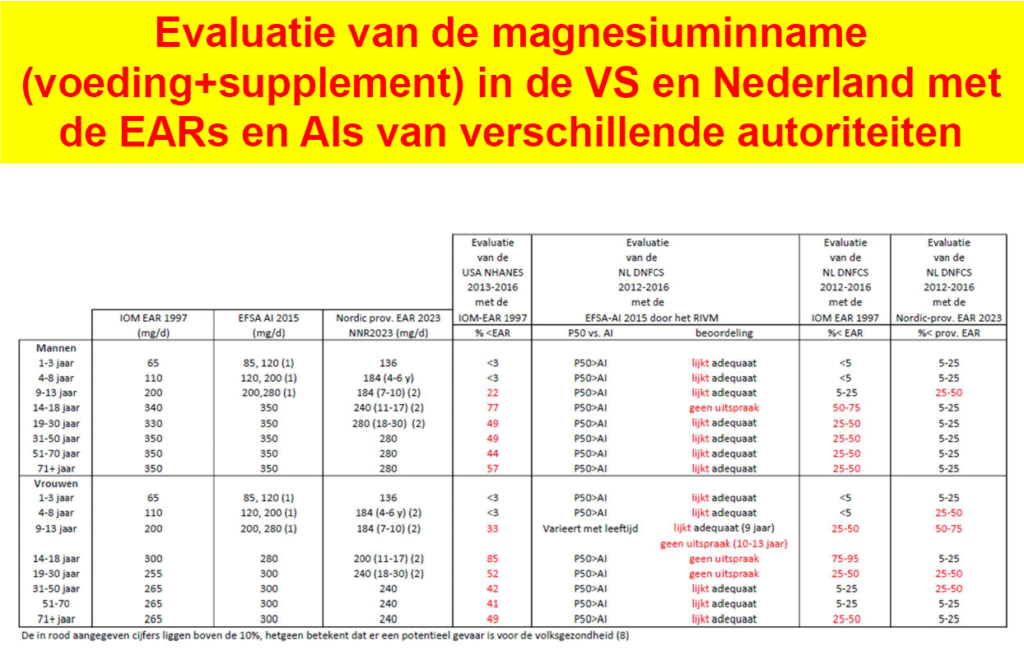
Het RIVM stelt dat de magnesiuminname van Nederlanders ‘adequaat lijkt’. Wie de cijfers naast de Amerikaanse en Scandinavische voedingsnormen legt, komt tot een andere conclusie. Ruim een kwart van de volwassen bevolking boven de 9 jaar heeft een te lage gebruikelijke magnesiuminname.
Het afserveren van voedingssupplementen is tegenwoordig een bron van volksvermaak. Vitamine C en magnesium zijn populaire koppen van jut.
Gesteund door hooggeleerden en andere als ‘experts’ opgevoerde wetenschappers, roepen Arjen Lubach, Antoinette Hertsenberg en de zelfbenoemde deskundige ‘Sjamadriaan’ om het hardst dat de aanschaf ervan ‘weggegooid geld, oplichterij en kwakzalverij’ is. Wat opvalt is het gebrek aan feiten en de zwart-wit opinies. Toegegeven, het is geen makkelijke kost. Maar als je het niet weet, is het meestal beter om je mond te houden.
Een manier om tot verifieerbare feiten te komen, is om de gebruikelijke magnesiuminnames, zoals die bepaald zijn in de voedselconsumptiepeilingen in de Verenigde Staten en Nederland, te toetsen aan de voedingsnormen van de National Academy of Medicine (Verenigde Staten), de Europese Autoriteit voor voedselveiligheid (EFSA) en de Scandinavische landen. En uiteraard te kijken wat ons eigen Rijksinstituut voor Volksgezondheid en Milieu (RIVM) ervan vindt.
Voedingsnormen voor magnesium en hun gebruik
Zoals al vaker in Uitzicht beschreven, zijn de huidige voedingsnormen van de gezaghebbende autoriteiten bepaald niet onwrikbaar. Zo bestaan er internationaal vaak grote verschillen in de normen, maar ook in hun gebruik. In Europa, en daarmee in Nederland, wordt voor magnesium de Adequate Inname (AI) norm van de EFSA gebruikt (Tabel 1, linkerdeel). Echter, met een AI kunnen de uitkomsten van een voedselconsumptiepeiling niet goed worden beoordeeld. Om toch een uitspraak te kunnen doen, hebben de Scandinavische landen op grond van deze AI van de EFSA een voorlopige gemiddelde behoefte – Estimated Average Requirement (EAR) – geschat. In de Verenigde Staten gebruikt men een eigen EAR die volgens hen ook wetenschappelijk is onderbouwd (zie verderop). Op grond van statistische overwegingen wordt in de Voedingswetenschap geen potentieel volksgezondheidsprobleem verwacht als minder dan 10 procent van de deelnemers een gebruikelijke inname heeft onder de EAR.
Magnesiumnormen in de voedselconsumptiepeiling
Het RIVM concludeert op basis van de Europese AI dat de magnesiuminname voor de meeste sekse en leeftijdsgroepen ‘adequaat lijkt’ (Tabel 1). De Amerikanen rapporteren al jaren dat de 9-jarigen en ouder niet voldoen aan de 10 procent-norm. Uit tabel 1 blijkt dat 22-85 procent een gebruikelijke inname heeft onder de EAR. Een projectie van de Amerikaanse EAR op de uitkomsten van de Nederlandse voedselconsumptiepeiling laat zien dat de 10 procent-norm in Nederland tenminste wordt overschreden voor mannen van 14 tot 71-jaar-en-ouder, en voor vrouwen van 9 tot 30 en 71-jaar-en-ouder. Bij gebruik van de Scandinavische voorlopige EAR is dit het geval voor mannen van 9 tot 13 jaar en ook voor vrouwen van 4 tot 13 jaar en van 19 tot 50 jaar (Tabel 1).
WC-eend kan er nog een hoop van leren….
Waarom zijn er verschillen in de beoordelingen?
Deze komen bijna geheel op het conto van verschillen in de gehanteerde EAR’s door de VS en de Scandinavische landen. Zulke verschillen zijn in de Voedingswetenschap niet ongebruikelijk, maar erger is dat geen van beide normen de toets van wetenschappelijke kritiek kunnen doorstaan. De Europese norm en de daarvan afgeleide voorlopige Scandinavische norm zijn gebaseerd op wat (schijnbaar) gezonde mensen in Europa zoal aan magnesium eten. Het gaat om negen landen (Finland, Frankrijk, Duitsland, Ierland, Italië, Letland, Nederland, Zweden en het Verenigd Koninkrijk), waartoe dus ook Nederland behoorde. Deze innames werden vervolgens tot een norm verheven. Het werd een AI en de Scandinavische landen maakten er een voorlopige EAR van. Een middelbare scholier zal begrijpen dat als je zo’n norm vervolgens op één van deze landen projecteert, je zelfgenoegzaam tot de conclusie komt dat zo’n land voldoet aan de norm. WC-eend kan er nog een hoop van leren…
Ook de Amerikaanse magnesiumnorm is niet onwrikbaar
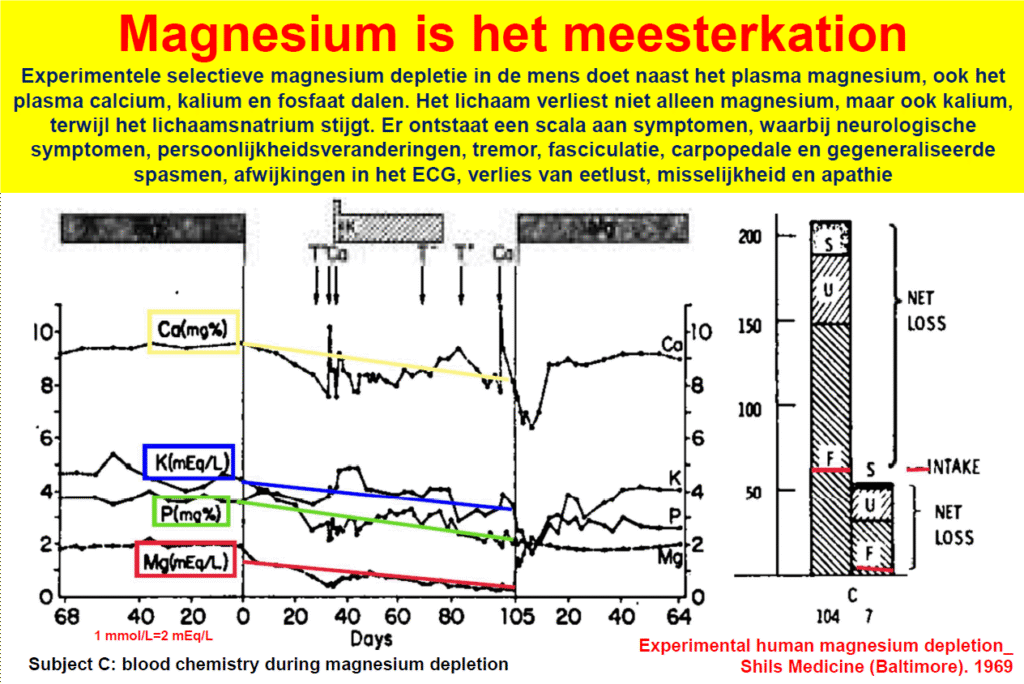
De Amerikaanse magnesiumnorm heeft een meer wetenschappelijke basis, maar ook die is niet onwrikbaar. Deze stoelt op een ‘balansstudie’, waarbij men vaststelt bij welke inname van magnesium eenzelfde hoeveelheid magnesium het lichaam via de urine en feces ook weer verlaat. Deze minimale inname werd de Amerikaanse norm. Het probleem is dat deze balans met de buitenwereld niet betekent dat er ook balans in het lichaam heerst.
Want wanneer een magnesiumtekort dreigt, wordt de magnesiumvoorraad in onze botten aangesproken om tekorten in de weefsels te voorkomen. De balans met de buitenwereld wordt behouden, maar het gaat ten koste van het bot. Omdat de hoeveelheid magnesium in het bloed daarbij nauwelijks daalt is magnesium in het plasma ongeschikt voor het vaststellen van de magnesiumstatus. Laatstgenoemde baseert zich onder andere op een intussen 55 jaar oude studie waarbij mensen experimenteel magnesium deficiënt werden gemaakt. Nagenoeg alle magnesiumspecialisten zijn het erover eens dat het plasma magnesium gehalte van schijnbaar gezonde personen niet moet worden gebruikt om de magnesiumstatus vast te stellen.
Wat de huidige magnesiumvoedingsnormen ook al niet sterk maakt, is dat er geen rekening is gehouden met de interactie van magnesium met calcium, fosfaat, natrium, kalium en het zuur/base evenwicht. En ook al niet met het sindsdien toegenomen lichaamsgewicht.
Inzicht in de rol van onze evolutie
Belangrijk in deze ‘discussie’ is ook het gebrek aan inzicht in onze evolutie. Magnesium is overvloedig aanwezig in het zeewater en dat is ook de oorsprong van alle landleven. Voeding uit de zee (o.a. schelpdieren, zeewier) is magnesiumrijk. Op het land zit veel magnesium in planten en noten want het is een onderdeel van chlorofyl.
De voorouders van ons allen, de anatomisch-moderne homo sapiens, kwamen uit de Zuid-Afrikaanse kust en migreerden langs de toenmalige kusten en rivieren tot in het puntje van Zuid-Amerika. Onze voeding werd dus tienduizenden jaren lang betrokken uit de magnesiumrijke land-zeewater ecosystemen. Vanwege het altijd overvloedig-aanwezige magnesium was het in de evolutie niet nodig om magnesium via aparte hormonen in ons lichaam te reguleren. Dat maakt ons kwetsbaar als de magnesiuminname daalt. Dit geldt niet voor ons calcium, want dat wordt door tenminste 3 hormonen, waaronder vitamine D, gereguleerd. Als de magnesiuminname daalt krijgt calcium de overhand en dat is precies wat in de afgelopen 10.000 jaar is gebeurd.
Sinds de start van de gecombineerde landbouw-veeteelt revolutie, ongeveer tienduizend jaar geleden, daalde de magnesiuminname, terwijl de calciuminname steeg. Dat laatste vooral vanwege de consumptie van melk(producten) en voedselverrijking, maar ook door het gebruik van calciumsupplementen. Daarentegen daalde het magnesiumgehalte in onze gewassen. Dit is evident aangetoond voor granen. De huidige Nederlander eet te weinig (magnesiumrijke) groente. Slechts 27 procent van de Nederlandse volwassenen eet dagelijks tenminste 200 gram groente en slechts 19 procent komt aan tenminste 200 gram fruit. Door deze veranderingen is de verhouding tussen calcium en magnesium in bijvoorbeeld de VS sterk gestegen en is die momenteel ook in Nederland hoger dan wat door magnesiumspecialisten als gezond wordt gezien. In Tabel 2 worden de vermoedelijke redenen van de gestegen calcium/magnesium verhouding in onze voeding opgesomd.
Nadelen van een hoge calcium/magnesium verhouding
Calcium en magnesium strijden met elkaar voor hun opname in onze darmen en cellen, en vechten ook met elkaar om te voorkomen dat ze via onze urine worden uitgescheiden. Bij een stijgende calcium/magnesium verhouding in onze voeding wordt het steeds moeilijker om calcium buiten de cellen te houden. Dat is belangrijk omdat calcium wordt gebruikt om signalen van buiten door te geven naar het binnenste van een cel. Magnesium probeert dat weer te dempen, maar dat lukt niet als er een calciumovermaat heerst of er te weinig magnesium is. Het calcium in de cel krijgt dan de overhand.
Een te hoog calciumgehalte in een cel zet deze cel voortdurende ‘op tilt’. Betreft het bijvoorbeeld de cellen van onze spieren dan blijven deze aangespannen en ontspannen zich dus niet. Maar ook andere cellen worden getroffen, want magnesium is belangrijk in iedere cel. Reeds sinds de jaren 90 wordt een te hoog gehalte aan calcium in de cellen en in ons bloed geassocieerd met hartziekte, stolling, hartinfarct, hoge bloeddruk, verhoogde bloedglucose, insulineresistentie en te hoge insulinewaarden.
Is de Schijf van Vijf magnesiumrijk genoeg?
Kun je via de ‘Schijf van Vijf’ voldoende magnesium uit de voeding halen?
Het Voedingscentrum en RIVM lieten dat inderdaad zien. Momenteel halen Nederlanders van 1 tot 79 jaar de meeste magnesium uit granen en graanproducten (25 procent), en uit melkproducten en hun vervangers (17 procent). Deze twee voedingsmiddelen worden pas sinds de gecombineerde landbouw-veeteelt revolutie geconsumeerd. Vóór die tijd kwam de magnesium van de toen jagende en verzamelende mens vooral uit groene bladgroentes, noten en voeding uit het land-zeewater ecosysteem. Momenteel komt slechts 3 procent uit groentes, peulvruchten, fruit, noten, zaden en olijven en 1 procent uit vis, schaaldieren en amfibieën.
De oorzaak van de huidige te lage magnesiuminname ten opzichte van de huidige aanbeveling is dus vooral dat men zich niet houdt aan de ‘Schijf van Vijf’. Dat laat onverlet dat de huidige magnesiumvoedingsnormen, die het Voedingscentrum en RIVM voor de ‘Schijf van Vijf’ gebruikten, in de wetenschappelijke literatuur stevig worden bekritiseerd.
Samengevat
- Beoordeling van de huidige magnesiuminname in Nederland aan de hand van de huidige Amerikaanse en Scandinavische normen laat zien dat meer dan 25 procent van de Nederlanders ouder dan 9 jaar een te lage magnesiuminname heeft. Vooral vrouwen zitten onder de momenteel gebruikte norm. Negeren van deze onmiskenbare feiten maak een karikatuur van zowel de voedingsconsumptiepeilingen als van de huidige voedingsnormen.
- Wie eet volgens de ‘Schijf van Vijf’ krijgt voldoende magnesium binnen. Dat grote groepen Nederlanders een te lage magnesiuminname hebben komt dus omdat ze zich hier niet aan houden.
- De voor de ‘Schijf van Vijf’ gebruikte magnesiumvoedingsnormen zijn te laag: ze baseren zich op een onhoudbare wetenschappelijke basis. Bij het opstellen van de momenteel geldende magnesium voedingsnormen is bovendien geen rekening gehouden met de interactie van magnesium met calcium en het zuur/base evenwicht en het sindsdien toegenomen lichaamsgewicht van de gemiddelde mens. Ook onze evolutionaire afkomst is bij het samenstellen van de voedingsnormen genegeerd.
- De bewering dat ondanks een te lage magnesiuminname de magnesiumstatus in orde is, ridiculiseert de waarde van de voedselconsumptiepeilingen en gaat voorbij aan de door nagenoeg iedere wetenschapper onderkende ongeschiktheid om de magnesiumstatus te beoordelen aan de hand van het bloedplasma. Want als deze ‘normaal’ is, dat wil zeggen binnen de door laboratoria gehanteerde referentiewaarden, weten we reeds sinds 55 jaar dat er toch sprake kan zijn van een (ernstig) magnesiumtekort.
Conclusie
De krachtige uitspaken van journalisten en hun hooggeleerde zegslieden in de media zijn aantoonbaar incorrect en dienen dus te worden gekwalificeerd als ‘desinformatie en halve waarheden die de preventie van ziekte schaden’.
Tabel 1
Tabel 2

Referenties
De volledige lijst aan referenties kan worden gevonden in referenties 19 en 20.
Reports of RIVM, IOM, EFSA and Nordic
1. Van Rossum, C. T. M., Buurma-Rethans, E. J. M., Dinnissen, C. S., Beukers, M. H., Brants, H. A. M., & Ocké, M. C. (2020). The diet of the Dutch: Results of the Dutch national food consumption survey 2012-2016.
https://rivm.openrepository.com/entities/publication/5de8226b-7111-44c3-ab8c-25e8da9bb6ce
1a. RIVM. Groente en fruit. Accessed 28 september 2025
https://www.wateetnederland.nl/resultaten/richtlijnen/groente-en-fruit
4. Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington (DC): National Academies Press (US); 1997. PMID: 23115811.
https://pubmed.ncbi.nlm.nih.gov/23115811
5. Blomhoff, R., Andersen, R., Arnesen, E. K., Christensen, J. J., Eneroth, H., Erkkola, M., … & Trolle, E. (2023). Nordic nutrition recommendations 2023: integrating environmental aspects. Nordic Council of Ministers.
6. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). (2015). Scientific opinion on dietary reference values for magnesium. EFSA Journal, 13(7), 4186.
https://efsa.onlinelibrary.wiley.com/doi/abs/10.2903/j.efsa.2015.4186#
7. Moshfegh, A. J., Goldman, J. D., Rhodes, D. G., Clemens, J. C., & LaComb, R. (2013). Usual nutrient intake from food and beverages: What we eat in America. NHANES, 2016, 2019.
https://www.ars.usda.gov/ARSUserFiles/80400530/pdf/usual/Usual_Intake_gender_WWEIA_2013_2016.pdf
8. Murphy, S. P., & Poos, M. I. (2002). Dietary reference intakes: summary of applications in dietary assessment. Public health nutrition, 5(6a), 843-849.
Plasma magnesium as status biomarker
2. Vormann J. Magnesium: nutrition and metabolism. Mol Aspects Med. 2003 Feb-Jun;24(1-3):27-37. doi: 10.1016/s0098-2997(02)00089-4. PMID: 12537987.
https://pubmed.ncbi.nlm.nih.gov/12537987
3. Elin RJ. Assessment of magnesium status for diagnosis and therapy. Magnes Res. 2010 Dec;23(4):S194-8. doi: 10.1684/mrh.2010.0213. Epub 2010 Aug 24. PMID: 20736141.
https://pubmed.ncbi.nlm.nih.gov/20736141
Triage hypothesis of Ames
9. Ames BN. Low micronutrient intake may accelerate the degenerative diseases of aging through allocation of scarce micronutrients by triage. Proc Natl Acad Sci U S A. 2006 Nov 21;103(47):17589-94. doi: 10.1073/pnas.0608757103. Epub 2006 Nov 13. PMID: 17101959; PMCID: PMC1693790.
https://pubmed.ncbi.nlm.nih.gov/17101959
10. McCann JC, Ames BN. Vitamin K, an example of triage theory: is micronutrient inadequacy linked to diseases of aging? Am J Clin Nutr. 2009 Oct;90(4):889-907. doi: 10.3945/ajcn.2009.27930. Epub 2009 Aug 19. PMID: 19692494.
https://pubmed.ncbi.nlm.nih.gov/19692494
11. Ames BN. Prevention of mutation, cancer, and other age-associated diseases by optimizing micronutrient intake. J Nucleic Acids. 2010 Sep 22;2010:725071. doi: 10.4061/2010/725071. PMID: 20936173; PMCID: PMC2945683.
https://pubmed.ncbi.nlm.nih.gov/20936173
12. McCann JC, Ames BN. Adaptive dysfunction of selenoproteins from the perspective of the triage theory: why modest selenium deficiency may increase risk of diseases of aging. FASEB J. 2011 Jun;25(6):1793-814. doi: 10.1096/fj.11-180885. Epub 2011 Mar 14. PMID: 21402715.
https://pubmed.ncbi.nlm.nih.gov/21402715
13. Ames BN. Musings in the twilight of my career. Free Radic Biol Med. 2022 Jan;178:219-225. doi: 10.1016/j.freeradbiomed.2021.11.038. Epub 2021 Dec 1. PMID: 34863877.
https://pubmed.ncbi.nlm.nih.gov/34863877
‘Resnick’ papers
14. Resnick LM. Cellular calcium and magnesium metabolism in the pathophysiology and treatment of hypertension and related metabolic disorders. Am J Med. 1992 Aug 31;93(2A):11S-20S. doi: 10.1016/0002-9343(92)90290-r. PMID: 1387762.
https://pubmed.ncbi.nlm.nih.gov/1387762
15. Barbagallo M, Gupta RK, Dominguez LJ, Resnick LM. Cellular ionic alterations with age: relation to hypertension and diabetes. J Am Geriatr Soc. 2000 Sep;48(9):1111-6. doi: 10.1111/j.1532-5415.2000.tb04788.x. PMID: 10983912.
https://pubmed.ncbi.nlm.nih.gov/10983912
16. Barbagallo M, Dominguez LJ, Resnick LM. Magnesium metabolism in hypertension and type 2 diabetes mellitus. Am J Ther. 2007 Jul-Aug;14(4):375-85. doi: 10.1097/01.mjt.0000209676.91582.46. PMID: 17667214.
https://pubmed.ncbi.nlm.nih.gov/17667214
17. Paolisso G, Barbagallo M. Hypertension, diabetes mellitus, and insulin resistance: the role of intracellular magnesium. Am J Hypertens. 1997 Mar;10(3):346-55. doi: 10.1016/s0895-7061(96)00342-1. PMID: 9056694.
https://pubmed.ncbi.nlm.nih.gov/9056694
18. Rosanoff, A., Capron, E., Barak, P., Mathews, B., & Nielsen, F. (2015). Edible plant tissue and soil calcium: magnesium ratios: data too sparse to assess implications for human health. Crop and Pasture Science, 66(12), 1265-1277.
https://www.publish.csiro.au/cp/cp15085
Magnesium-calcium homeostase en evolutie (zie ook referenties hierin)
19. Muskiet FAJ. Calcium-magnesiumratio in de voeding belangrijk voor adequate magnesiumstatus deel 1. Voedingsgeneeskunde 2023;24(3):46-54
20. Muskiet FAJ. Calcium-magnesiumratio in de voeding belangrijk voor adequate magnesiumstatus deel 2. Voedingsgeneeskunde 2023:24(4):44-55
21. FAJ Muskiet, R. Wisman. Dokter Lubach vertelt en we lachen allemaal. Voedingsgeneeskunde 2023;24(5)38-43
https://www.voedingsgeneeskunde.nl/vg-24-5/dokter-lubach-vertelt-en-we-lachen-allemaal
22. Muskiet FAJ. Geef magnesiumtekort geen kans. Voorkom calciumtoxiciteit. Uitzicht 2023; 49 (5)10-13.
23. FAJ Muskiet. De optimale calcium-magnesium verhouding.Tijdschrift voor integrale geneeskinde 2024; 39 (2) 95-96
23a. Muskiet, F. A. (2018). Evolutionaire geneeskunde: De groei van onze hersenen heeft ons gevoelig gemaakt voor ‘typisch westerse’ziekten. Bijblijven, 34(5), 391-425.
https://link.springer.com/article/10.1007/s12414-018-0318-2
23b. Shils ME. EXPERIMENTAL HUMAN MAGNESIUM DEPLETION. I. CLINICAL OBSERVATIONS AND BLOOD CHEMISTRY ALTERATIONS. Am J Clin Nutr. 1964 Sep;15:133-43. doi: 10.1093/ajcn/15.3.133. PMID: 14212747.
https://pubmed.ncbi.nlm.nih.gov/14212747
23c. Shils ME. Experimental human magnesium depletion. Medicine (Baltimore). 1969 Jan;48(1):61-85. doi: 10.1097/00005792-196901000-00003. PMID: 5763574.
https://pubmed.ncbi.nlm.nih.gov/5763574
Bone mineral balance
24. Kodama N, Nishimuta M, Suzuki K. Negative balance of calcium and magnesium under relatively low sodium intake in humans. J Nutr Sci Vitaminol (Tokyo). 2003 Jun;49(3):201-9. doi: 10.3177/jnsv.49.201. PMID: 12953799.
https://pubmed.ncbi.nlm.nih.gov/12953799
25. Nishimuta M, Kodama N, Shimada M, Yoshitake Y, Matsuzaki N, Morikuni E. Estimated equilibrated dietary intakes for nine minerals (Na, K, Ca, Mg, P, Fe, Zn, Cu, and Mn) adjusted by mineral balance medians in young Japanese females. J Nutr Sci Vitaminol (Tokyo). 2012;58(2):118-28. doi: 10.3177/jnsv.58.118. Erratum in: J Nutr Sci Vitaminol (Tokyo). 2012;58(3):221. PMID: 22790570.
https://pubmed.ncbi.nlm.nih.gov/22790570
26. Zaichick S, Zaichick V. The effect of age and gender on 38 chemical element contents in human iliac crest investigated by instrumental neutron activation analysis. J Trace Elem Med Biol. 2010 Jan;24(1):1-6. doi: 10.1016/j.jtemb.2009.07.002. Epub 2009 Aug 21. PMID: 20122572.
https://pubmed.ncbi.nlm.nih.gov/20122572
27. Green J, Kleeman CR. Role of bone in regulation of systemic acid-base balance. Kidney Int. 1991 Jan;39(1):9-26. doi: 10.1038/ki.1991.2. PMID: 1706001.
https://pubmed.ncbi.nlm.nih.gov/1706001
Plasma magnesium optimal value >0.85 mmol/L
28. Costello RB, Elin RJ, Rosanoff A, Wallace TC, Guerrero-Romero F, Hruby A, Lutsey PL, Nielsen FH, Rodriguez-Moran M, Song Y, Van Horn LV. Perspective: The Case for an Evidence-Based Reference Interval for Serum Magnesium: The Time Has Come. Adv Nutr. 2016 Nov 15;7(6):977-993. doi: 10.3945/an.116.012765. PMID: 28140318; PMCID: PMC5105038.
https://pubmed.ncbi.nlm.nih.gov/28140318
29. Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS. Evidence based medicine: what it is and what it isn’t. BMJ. 1996 Jan 13;312(7023):71-2. doi: 10.1136/bmj.312.7023.71. PMID: 8555924; PMCID: PMC2349778.
https://pubmed.ncbi.nlm.nih.gov/8555924
29a. Hill AB. The environment and disease: association or causation? 1965. J R Soc Med. 2015 Jan;108(1):32-7. doi: 10.1177/0141076814562718. PMID: 25572993; PMCID: PMC4291332.
https://pubmed.ncbi.nlm.nih.gov/25572993
30. Nielsen FH. Guidance for the determination of status indicators and dietary requirements for magnesium. Magnes Res. 2016 Apr 1;29(4):154-160. doi: 10.1684/mrh.2016.0416. PMID: 28132953.
https://pubmed.ncbi.nlm.nih.gov/28132953
31. Oria, M. P., & Kumanyika, S. (Eds.). (2017). Guiding principles for developing dietary reference intakes based on chronic disease.
Dietary calcium/magnesium ratio in The Netherlands.
32. Van Rossum, C. T. M., Fransen, H. P., Verkaik-Kloosterman, J., & Buurma-Rethans, E. (2007). JM, and Ocke, MC (2011). Dutch National Food Consumption Survey 2007–2010: Diet of Children and Adults Aged 7 to 69 Years.
https://www.rivm.nl/bibliotheek/rapporten/350050006.pdf
33. RIVM De zorg voor morgen begint vandaag. DNFCS2012-2016: Usual intake of macro- and micronutrients from foods only
https://statline.rivm.nl/#/RIVM/nl/dataset/50073NED/table?ts=1583229881203
Magnesium intakes and calcium/magnesium ratios, e.g. from the ‘Schijf van Vijf’
34. Brink E, van Rossum C, Postma-Smeets A, Stafleu A, Wolvers D, van Dooren C, Toxopeus I, Buurma-Rethans E, Geurts M, Ocké M. Development of healthy and sustainable food-based dietary guidelines for the Netherlands. Public Health Nutr. 2019 Sep;22(13):2419-2435. doi: 10.1017/S1368980019001435. Epub 2019 Jul 2. PMID: 31262374; PMCID: PMC7083597.
https://pubmed.ncbi.nlm.nih.gov/31262374
34a. Richtlijnen voedselkeuze, Publicatiedatum 1 maart 2011; update 12 april 2011
35. Pietrzak-Fiećko R, Kamelska-Sadowska AM. The Comparison of Nutritional Value of Human Milk with Other Mammals’ Milk. Nutrients. 2020 May 14;12(5):1404. doi: 10.3390/nu12051404. PMID: 32422857; PMCID: PMC7284997.
https://pubmed.ncbi.nlm.nih.gov/32422857
36. Dror DK, Allen LH. Overview of Nutrients in Human Milk. Adv Nutr. 2018 May 1;9(suppl_1):278S-294S. doi: 10.1093/advances/nmy022. PMID: 29846526; PMCID: PMC6008960.
https://pubmed.ncbi.nlm.nih.gov/29846526
37. Association of maternal diet, micronutrient status, and milk volume with milk micronutrient concentrations in Indonesian mothers at 2 and 5 months postpartum_Gibson Am J Clin Nutr. 2020
https://pubmed.ncbi.nlm.nih.gov/32844187
38. Chekri, R., Noël, L., Millour, S., Vastel, C., Kadar, A., Sirot, V., … & Guérin, T. (2012). Calcium, magnesium, sodium and potassium levels in foodstuffs from the second French Total Diet Study. Journal of Food Composition and Analysis, 25(2), 97-107.
https://www.sciencedirect.com/science/article/abs/pii/S0889157511002043
39. Schroll, A. (1998). Importance of magnesium for the electrolyte homeostasis–an overview. In Advances in Magnesium Research: Magnesium in Cardiology: Proceedings of the 5th European Congress on Magnesium. London: John Libbey Company (pp. 463-72).
https://scholar.google.nl/scholar?hl=nl&as_sdt=0%2C5&q=Schroll+A.+Importance+of+magnesium+for+the+electrolyte+homeostasis%E2%80%93an+overview.+1998%3B463-72.&btnG=#d=gs_cit&t=1683363895810&u=%2Fscholar%3Fq%3Dinfo%3Ay6dx22Ef0b4J%3Ascholar.google.com%2F%26output%3Dcite%26scirp%3D0%26hl%3Dnl see also http://www.mgwater.com/schroll.shtml
40. Rosanoff A. Perspective: US Adult Magnesium Requirements Need Updating: Impacts of Rising Body Weights and Data-Derived Variance. Adv Nutr. 2021 Mar 31;12(2):298-304. doi: 10.1093/advances/nmaa140. PMID: 33179034; PMCID: PMC8009744.
https://pubmed.ncbi.nlm.nih.gov/33179034
Plasma magnesium reference values are not optimal values
41. Vijf vragen over magnesium aan Jeroen de Baaij. Wat klopt er van de gezondheidsclaims van influencers op sociale media? 10 oktober 2023; Accessed 28 september 2025
https://www.radboudumc.nl/nieuws/2023/vijf-vragen-over-magnesium-aan-jeroen-de-baaij
42. de Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev. 2015 Jan;95(1):1-46. doi: 10.1152/physrev.00012.2014. PMID: 25540137.
https://pubmed.ncbi.nlm.nih.gov/25540137
43. Rosanoff A, West C, Elin RJ, Micke O, Baniasadi S, Barbagallo M, Campbell E, Cheng FC, Costello RB, Gamboa-Gomez C, Guerrero-Romero F, Gletsu-Miller N, von Ehrlich B, Iotti S, Kahe K, Kim DJ, Kisters K, Kolisek M, Kraus A, Maier JA, Maj-Zurawska M, Merolle L, Nechifor M, Pourdowlat G, Shechter M, Song Y, Teoh YP, Touyz RM, Wallace TC, Yokota K, Wolf F; MaGNet Global Magnesium Project (MaGNet). Recommendation on an updated standardization of serum magnesium reference ranges. Eur J Nutr. 2022 Oct;61(7):3697-3706. doi: 10.1007/s00394-022-02916-w. Epub 2022 Jun 10. PMID: 35689124; PMCID: PMC9186275.
https://pubmed.ncbi.nlm.nih.gov/35689124
44. de Baaij JHF, Bockenhauer D, Claverie-Martin F, Hoenderop JGJ, Hoorn EJ, Houillier P, Knoers NVAM, Konrad M, Müller D, Nijenhuis T, Schlingmann KP, Vargas Poussou R. Comment to “Recommendation on an updated standardization of serum magnesium reference ranges”. Eur J Nutr. 2022 Dec;61(8):4231-4233. doi: 10.1007/s00394-022-03004-9. Epub 2022 Sep 27. PMID: 36168067.
https://pubmed.ncbi.nlm.nih.gov/36168067
45. Touyz RM, Wolf F, Maier JA, Rosanoff A, West C, Elin RJ, Micke O, Baniasadi S, Barbagallo M, Campbell E, Cheng FC, Costello RB, Gamboa-Gomez C, Guerrero-Romero F, Gletsu-Miller N, von Ehrlich B, Iotti S, Kahe K, Kim DJ, Kisters K, Kolisek M, Kraus A, Maj-Zurawska M, Merolle L, Nechifor M, Pourdowlat G, Shechter M, Song Y, Teoh YP, Wallace TC, Yokota K; MaGNet Global Magnesium Project (MaGNet). Reply to “Recommendation on an updated standardization of serum magnesium reference ranges,” Jeroen H.F. de Baaij et al. Eur J Nutr. 2022 Dec;61(8):4235-4237. doi: 10.1007/s00394-022-03005-8. Epub 2022 Oct 7. PMID: 36207423.
https://pubmed.ncbi.nlm.nih.gov/36207423
46. Touyz RM, de Baaij JHF, Hoenderop JGJ. Magnesium Disorders. N Engl J Med. 2024 Jun 6;390(21):1998-2009. doi: 10.1056/NEJMra1510603. PMID: 38838313.
https://pubmed.ncbi.nlm.nih.gov/38838313
47. Elin RJ. Assessment of magnesium status. Clin Chem. 1987 Nov;33(11):1965-70. PMID: 3315301.
https://pubmed.ncbi.nlm.nih.gov/3315301
48. Ralston MA, Murnane MR, Kelley RE, Altschuld RA, Unverferth DV, Leier CV. Magnesium content of serum, circulating mononuclear cells, skeletal muscle, and myocardium in congestive heart failure. Circulation. 1989 Sep;80(3):573-80. doi: 10.1161/01.cir.80.3.573. PMID: 2766510.
https://pubmed.ncbi.nlm.nih.gov/2766510
49. Ryzen E, Elkayam U, Rude RK. Low blood mononuclear cell magnesium in intensive cardiac care unit patients. Am Heart J. 1986 Mar;111(3):475-80. doi: 10.1016/0002-8703(86)90051-7. PMID: 3953355.
https://pubmed.ncbi.nlm.nih.gov/3953355
50. Schutten JC, Post A, van der Meer M, IJmker J, Goorman F, Danel RM, Vervloet MG, de Borst MH, Touw DJ, Bakker SJL. Comparison of two methods for the assessment of intra-erythrocyte magnesium and its determinants: Results from the LifeLines cohort study. Clin Chim Acta. 2020 Nov;510:772-780. doi: 10.1016/j.cca.2020.09.007. Epub 2020 Sep 11. PMID: 32919943.
https://pubmed.ncbi.nlm.nih.gov/32919943
Magnesium and diabetes
51. Gommers LM, Hoenderop JG, Bindels RJ, de Baaij JH. Hypomagnesemia in Type 2 Diabetes: A Vicious Circle? Diabetes. 2016 Jan;65(1):3-13. doi: 10.2337/db15-1028. PMID: 26696633.
https://pubmed.ncbi.nlm.nih.gov/26696633
52. Kostov K. Effects of Magnesium Deficiency on Mechanisms of Insulin Resistance in Type 2 Diabetes: Focusing on the Processes of Insulin Secretion and Signaling. Int J Mol Sci. 2019 Mar 18;20(6):1351. doi: 10.3390/ijms20061351. PMID: 30889804; PMCID: PMC6470576.
https://pubmed.ncbi.nlm.nih.gov/30889804
53. de Sousa Melo SR, Dos Santos LR, da Cunha Soares T, Cardoso BEP, da Silva Dias TM, Morais JBS, de Paiva Sousa M, de Sousa TGV, da Silva NC, da Silva LD, Cruz KJC, do Nascimento Marreiro D. Participation of Magnesium in the Secretion and Signaling Pathways of Insulin: an Updated Review. Biol Trace Elem Res. 2022 Aug;200(8):3545-3553. doi: 10.1007/s12011-021-02966-x. Epub 2022 Jun 6. PMID: 35666386.
https://pubmed.ncbi.nlm.nih.gov/35666386
54. Simental-Mendía LE, Sahebkar A, Rodríguez-Morán M, Guerrero-Romero F. A systematic review and meta-analysis of randomized controlled trials on the effects of magnesium supplementation on insulin sensitivity and glucose control. Pharmacol Res. 2016 Sep;111:272-282. doi: 10.1016/j.phrs.2016.06.019. Epub 2016 Jun 18. PMID: 27329332.
https://pubmed.ncbi.nlm.nih.gov/27329332
55. Kurstjens S, de Baaij JH, Bouras H, Bindels RJ, Tack CJ, Hoenderop JG. Determinants of hypomagnesemia in patients with type 2 diabetes mellitus. Eur J Endocrinol. 2017 Jan;176(1):11-19. doi: 10.1530/EJE-16-0517. Epub 2016 Oct 5. PMID: 27707767.
https://pubmed.ncbi.nlm.nih.gov/27707767
56. Asbaghi O, Moradi S, Kashkooli S, Zobeiri M, Nezamoleslami S, Hojjati Kermani MA, Lazaridi AV, Miraghajani M. The effects of oral magnesium supplementation on glycaemic control in patients with type 2 diabetes: a systematic review and dose-response meta-analysis of controlled clinical trials. Br J Nutr. 2022 Dec 28;128(12):2363-2372. doi: 10.1017/S0007114521005201. Epub 2022 Jan 20. PMID: 35045911.
https://pubmed.ncbi.nlm.nih.gov/35045911
57. Drenthen LCA, de Baaij JHF, Rodwell L, van Herwaarden AE, Tack CJ, de Galan BE. Oral magnesium supplementation does not affect insulin sensitivity in people with insulin-treated type 2 diabetes and a low serum magnesium: a randomised controlled trial. Diabetologia. 2024 Jan;67(1):52-61. doi: 10.1007/s00125-023-06029-9. Epub 2023 Nov 3. PMID: 37922013; PMCID: PMC10709477.
https://pubmed.ncbi.nlm.nih.gov/37922013
58. Kröse JL, de Baaij JHF. Magnesium biology. Nephrol Dial Transplant. 2024 Nov 27;39(12):1965-1975. doi: 10.1093/ndt/gfae134. Erratum in: Nephrol Dial Transplant. 2025 May 30;40(6):1261. doi: 10.1093/ndt/gfae219. PMID: 38871680; PMCID: PMC11648962.
https://pubmed.ncbi.nlm.nih.gov/38871680
59. Paolisso G, Barbagallo M. Hypertension, diabetes mellitus, and insulin resistance: the role of intracellular magnesium. Am J Hypertens. 1997 Mar;10(3):346-55. doi: 10.1016/s0895-7061(96)00342-1. PMID: 9056694.
https://pubmed.ncbi.nlm.nih.gov/9056694
60. Xu LH, Maalouf NM. Effect of acute hyperinsulinemia on magnesium homeostasis in humans. Diabetes Metab Res Rev. 2017 Feb;33(2). doi: 10.1002/dmrr.2844. Epub 2016 Sep 26. PMID: 27546733.
MMV maakt wekelijks een selectie uit het nieuws over voeding en leefstijl in relatie tot kanker en andere medische condities.
Inschrijven nieuwsbrief








